Den utbredda användningen av små hushållsapparater bland konsumenter medför behov av strömkällor, eller kretsar med en enda strömförsörjning. galvaniska celler, allmänt kända som batterier. De dök först upp år 1800, tack vare den italienska fysikern Alessandro Volta. De varierar i storlek och form, spänning, kapacitet och batterityp. Alkaliska och saltlösningsbatterier används ofta på marknaden för små apparater och elektronik.
Vad är saltlösningsbatterier?
Saltbatterier — källor till elektrisk ström som genereras i en enkel anordning genom en kemisk reaktion. De kallas ibland kol-zink-batterier eller kolbatterier. Denna typ av cell anses vara den billigaste, men har en låg energitäthet, vilket gör den väl lämpad för lågenergienheter. I enheter med hög strömförbrukning eller med karakteristiska ökningar i belastningsström och temperatur håller de inte länge och används därför inte.
Beteckning av saltbatterier
Beteckningen av saltlösningsbatterier accepteras enligt flera standarder:
- Amerikanskt klassificeringssystem.
- Internationella systemet (IEC).
- Mellanstatlig standard (GOST).
| Amerikanskt klassificeringssystem | Internationell klassificering IEC | GOST | Storlek, mm | Kapacitet, mAh |
| En | R23 | 17x50 | ||
| AA | R6 | 316 | 14,5x50,5 | 1100 |
| AAA | R03 | 286 | 10,5x44,5 | 540 |
| C | R14 | 343 | 26,2x50 | 3800 |
| D | R20 | 373 | 34,2x61,5 | 8000 |
| F | 25 kr | 33x91 | ||
| 1/2AA | 14250 kr | 312 | 14,5x25 | 250 |
| R10 | R10 | 332 | 21,5x37,3 | 1800 |
Till exempel betyder märkningen på ett saltlösningsbatteri R 6: rund, cylindrisk, finger, saltelement, totala mått 14,5x50,5, kapacitet1100 mAh. Standardspänningen är 1,5 V. Beteckningen "R" (salt) på batterietiketten skiljer saltlösningsbatterier från andra typer av batterier (alkaliska eller litiumbatterier).
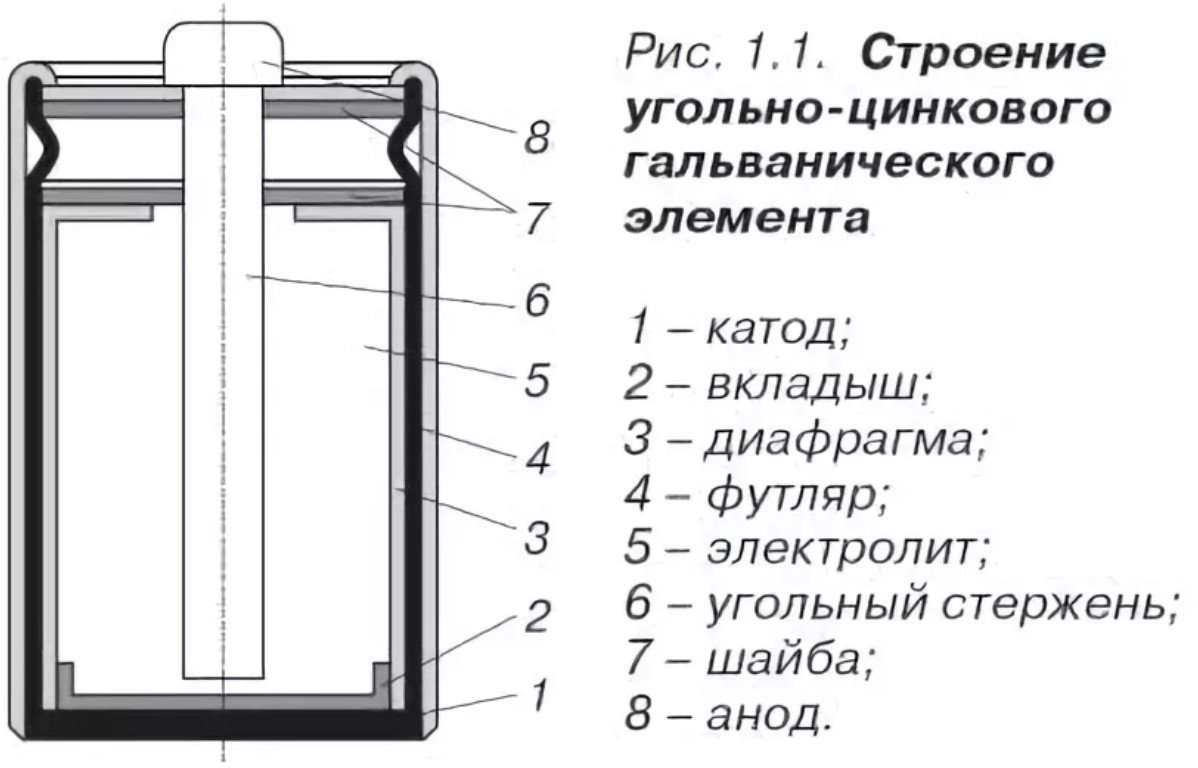
Design och komposition
Designen av ett saltbatteri är ganska enkel och består av:
- Katod - samma saltbatteriets hölje är tillverkat tillverkad av zink, med förbättrade korrosionsskyddande egenskaper och en hög reningsgrad (minus).
- Anoden är ett agglomerat, tillverkat genom pressning, impregnerat med elektrolyt (plus).
- Elektrolyt: ammoniumklorid eller zinkklorid, med tillsats av ett förtjockningsmedel (stärkelse).
- Kolströmsledare - löper genom mitten, behandlad med paraffinkomposition.
- Gaskammare - belägen högst upp, utformad för att samla gaser från den kemiska reaktionen.
- Packning - placerad högst upp, fungerar som tätningsmedel.
- Skyddsfodral - kartong eller plåt för att skydda mot korrosion och elektrolytläckage.
Låt oss betrakta sammansättningen av ett saltbatteri ur en kemisk synvinkel:
- Katoden är högrenad zink, motståndskraftig mot korrosion.
- Anod - MnO-blandning2, grafit, elektrolytimpregnering.
- Elektrolyten är ammoniumklorid, eller en blandning av zinkklorid och kalciumklorid.
Vilka batterier är bättre: saltlösning (1) eller alkaliska (2)?
Jämförelsen kan göras i form av en tabell, där fördelarna och nackdelarna med olika typer av element tydligt framgår:
| Jämförelseparametrar | 1 | 2 |
| Temperaturförhållanden, driftsförhållanden | Prestandan minskar vid låga temperaturer och tål inte strömtoppar. | Fungerar bra vid låga temperaturer - ner till -20O, tål lätt överspänningar, är inte rädda för en kraftig ökning av lastströmmen |
| Bäst före-datum | 2–3 år | 5 år |
| Ansökan | Lämplig för användning i enheter med låg strömförbrukning | Lämplig för användning i utrustning med medelhög och hög energiförbrukning |
| Instrument, tekniska apparater | Väckarklockor, väggklockor, fjärrkontroller, minificklampor, enkla leksaker | Spelare, ficklampor, musikleksaker, röstinspelare, blodtrycksmätare |
När du väljer en strömkälla för en enhet med specifika driftskrav är det viktigt att veta hur man skiljer mellan ett saltlösningsbatteri och ett alkaliskt batteri. Medan saltlösningsbatterier är markerade med bokstaven R, föregås alkaliska batterier av bokstaven L (LR).
Slutsatser och rekommendationer
Denna typ av strömkälla är lättare och billigare. Saltlösningsbatteriers hållbarhet är dock kort – 2 till 3 år – och de kan genomgå partiell självurladdning under förvaring och under användning vid en plötslig strömtopp. Med tanke på deras relativt dåliga prestanda men relativt låga kostnad är det därför enkelt att köpa flera uppsättningar batterier som reserv.
Inte lång kapacitetsaltbatterier (2-3 gånger mindre än andra typer) begränsar deras användning till enkla enheter med låg belastningsström.
Det är enkelt att avgöra om det är möjligt att ladda saltlösningsbatterier: batteriets namn anges på enhetens hölje som är avsedd för laddning. kapacitetI mAh. Om detta värde inte är tillgängligt är det ett vanligt batteri, och trots många expertråd bör det inte laddas. Att ladda det ger inte den förväntade långsiktiga effekten och kan leda till en olycka på grund av överhettning och elektrolytläckage. Om du behöver en mer pålitlig och hållbar strömkälla är det bättre att investera i ett alkaliskt alternativ eller ett laddningsbart batteri.
Intressant faktum: DIY saltbatteri Det kan göras mycket enkelt. Du behöver 50-kopekmynt, folie, papper och en saltlösning. Det är bäst att blötlägga mynten i en vinägerlösning före användning för att ta bort eventuell plack eller smuts. Montera enheten: ett mynt, papper indränkt i saltlösningen och folie. Upprepa denna process flera gånger och skapa en kolumn med myntet (positivt) i ena änden och folien (negativt) i den andra. Ström genereras av potentialskillnaden som skapas av elektrolyten (saltlösningen) mellan foliens metall och myntet. Denna uppfinning kallas en voltaisk stapel, och dess spänning beror direkt på antalet mynt som används: ju fler mynt det finns, desto högre spänning erhålls. Efter experimentet är mynten dock inte längre användbara; de kommer att ha en rostig beläggning.